miércoles, 27 de mayo de 2015
domingo, 24 de mayo de 2015
COMPUESTOS TERNARIOS: ÓXACIDOS
Compuestos Ternarios : Oxácidos
Son compuestos
ternarios formados por un no metal, oxígeno e hidrógeno. Se obtienen a partir
del óxido ácido o anhídrido correspondiente sumándole una molécula de agua
(H2O).

Casos especiales As, P, Sb, B
Dan tres tipos de
oxácidos:
•Anhídrido + H2O → Ácido meta-(anhídrido)
•Anhídrido + 2 H2O → Ácido piro-(anhídrido)
•Anhídrido + 3 H2O → Ácido orto-(anhídrido) .
Bibliografía
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
COMPUESTOS TERNARIOS: HIDRÓXIDOS
Compuestos Ternarios: Hidróxidos
Los hidróxidos son compuestos constituidos por tres elementos: un metal, oxígeno e hidrógeno. En los hidróxidos metálicos el oxígeno y el hidrógeno se
encuentran formando uno o más grupos OH (grupos hidroxilo).
Es la combinación que deriva del agua por substitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
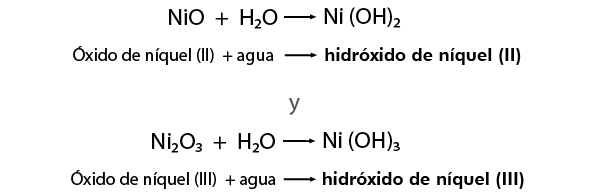
Bibliografía
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
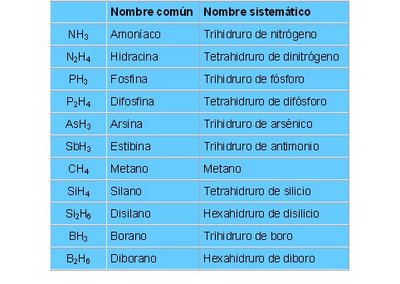
COMPUESTO ESPECIALES
Compuestos Especiales
Los hidruros que surgen de combinar el Hidrógeno con un no metal ( de la tercera o cuarta familia), se nombran de forma especial.
Bibliografía
- Material DidácticaQuímica 15
HIDRÁCIDOS
Hidrácidos: es la combinación del hidrógeno con un no metal
(de la primera o segunda familia). El H tiene valencia +1.
Los hidrácidos se forman por la combinación de un no metal que trabaja con su valencia negativa (-) y el hidrógeno (H con valencia 1) + el no metal (con la valencia -). Se intercambian valencias.
Bibliografía
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
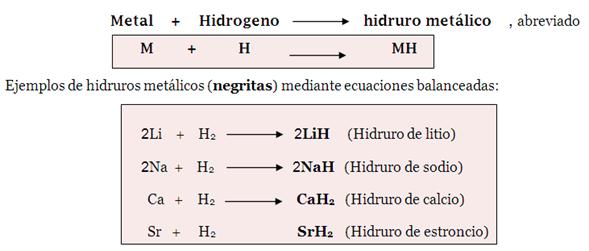
COMPUESTOS BINARIOS: HIDRUROS
Compuestos Binarios: Hidruros
Son combinaciones de hidrógeno junto un elemento metálico. en este tipo de compuestos los metales actúan con valencias positivas mientras que el hidrógeno actúan con valencia -1.
Los hidruros se formulan anteponiendo en primer lugar el metal seguido del hidrógeno siendo intercambiada sus valencias .
La formula de los hidruros es del tipo XHn (donde X es el elemento metálico, H es ele hidrógeno y n es la valencia del elemento metaálico).

Bibliografía
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
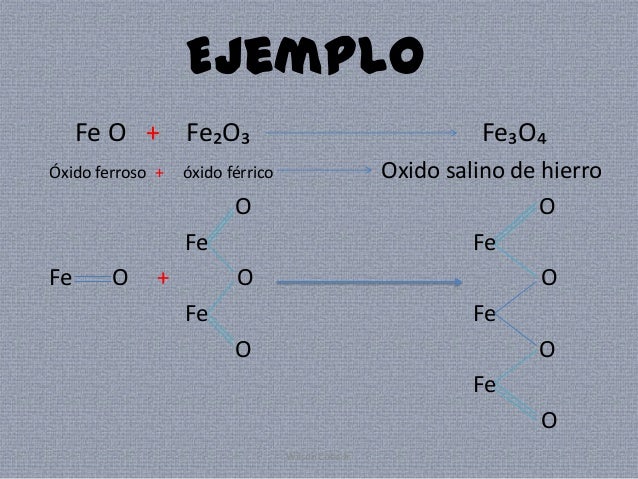
COMPUESTOS BINARIOS: ÓXIDOS SALINOS
Compuestos Binarios: Óxidos SALINOS
Resultan de unir o combinar 2 Óxidos simples de un solo
elemento. Son Óxidos
Binarios o también llamados Mixtos.
Son óxidos binarios o también llamados mixtos.
Bibliografía
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
miércoles, 20 de mayo de 2015
COMPUESTOS BINARIOS: PERÓXIDOS
Compuestos Binarios: Peróxidos
Primero se forma el óxido y luego se lo combina con un
átomo de oxígeno. Se forman con los
elementos del grupo I y II
.
Compuesto
|
NOMENCLATURA (I)
|
NOMENCLATURA (II)
|
BeO2
|
Dióxido de Berilio
|
Peróxido de Berilio
|
Li2O2
|
Dióxido de dilitio
|
Peróxido de litio
|
Rb2O2
|
dióxido de dirubidio
|
Peróxido de rubidio
|
SrO2
|
Dióxido de Estroncio
|
Peróxido de estroncio
|
Bibliografía
- Material DidácticaQuímica 15
COMPUESTOS BINARIOS: ÓXIDOS ÁCIDOS
Compuestos Binarios: Óxidos ÁCIDOS
Óxidos ácidos:Son combinaciones binarias de un no metal y el oxígeno, en las que análogamente a los anteriores el oxígeno utiliza el grado de oxidación.
SO3
NOMENCLATURA TRADICIONAL: trióxido de azufre.
NOMENCLATURA STOCK: óxido de azufre (VI).
NOMENCLATURA SISTEMÁTICA: Anhídrido sulfúrico.
Bibliografía
- http://iiquimica.blogspot.com/2006/04/nomenclatura-inorgnica-compuestos.html
- Material DidácticaQuímica 15
- http://es.slideshare.net/luiggidemora/trabajo-de-fisica-daniella-nivela-y-andrea-ordoez
COMPUESTOS BINARIOS: ÓXIDOS BÁSICOS
Compuestos Binarios: Óxidos Básicos
COMPUESTOS BINARIOS:
1. Óxidos básicos: Son combinaciones binarias de un metal con el oxígeno en las que el oxígeno utiliza el grado o estado de oxidación

Bibliografía
- http://iiquimica.blogspot.com/2006/04/nomenclatura-inorgnica-compuestos.html
- Material DidácticaQuímica 15
SISTEMAS DE NOMENCLATURAS
Sistemas de Nomenclatura
NOMENCLATURA TRADICIONAL:
El sistema tradicional comienza con el nombre del hidróxido y luego va la terminación oso si se trata del menor número de oxidación e ico si se trata del mayor número de oxidación. Si el elemento tiene un solo número de oxidación, simplemente se utiliza el número del metal.
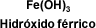
NOMENCLATURA STOCK:
La nomenclatura Stock, utiliza el nombre genérico (hidróxido) y el nombre del metal, colocando adicionalmente entre paréntesis en números romanos el número de oxidación del elemento unido al OH-, cuando se trata de elementos con más de un número de oxidación. Esto se omite cuando el elemento tiene un solo número de oxidación.
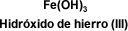
NOMENCLATURA SISTEMÁTICA:
La nomenclatura sistemática utiliza los prefijos di, tri, tetra, etc., si la fórmula presenta dos, tres o cuatro grupos OH-respectivamente y así sucesivamente en caso de presentar más. Las normas sistemáticas establecidas por la IUPAC vienen recomendándose para su aplicación a fin de sustituir progresivamente al sistema de nomenclatura tradicional.
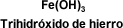
Bibliografía
- http://www.proyectosalonhogar.com/Enciclopedia_Ilustrada/Ciencias/Nomenclatura/indice.htm
- Material didáctico Química 15
REGLAS PARA FORMAR COMPUESTOS
REGLAS PARA FORMAR COMPUESTOS
- El hidrógeno (H) presenta número de oxidación +1 con los no metales y –1 con los metales.
- El oxígeno (O) presenta el número de oxidación –2, excepto en los peróxidos donde es –1.
- El compuesto se lee de derecha a izquierda
- Se intercambian las valencias, pero prescindiendo del Signo
- Siempre que sea posible se simplifica:
Cu2S2 " CuS
En cualquier fórmula
química se escribe en primer lugar los elementos situados a la izquierda de la
Tabla periódica (menos electronegativos) y en segundo lugar, los situados a la derecha (más electronegativos)
COMPUESTOS
Compuestos






Es una sustancia formada por la unión de dos o más elementos de la tabla periódica. Son aquellas sustancias que están compuestas por la unión de al menos dos elementos incluidos en la tabla periódica.
SE CLASIFICAN EN:
Óxidos Básicos: Esta formados por un metal y un oxigeno.

Óxidos Ácidos : Estos compuestos, en cambio, están formados por un oxígenos y un no metal.

HIDRUROS: Estos compuestos pueden ser no metálicos o metálicos y sus componentes son un hidrógeno y algún otro elemento.
M+O

HIDRÁCIDOS: Es la unión de un no metal y un oxigeno.
NM+O

HIDRÓXIDOS: Es la unión de un metal mas un hidrógeno.
M + (OH)-1

OXÁCIDOS: Es la unión de un Anhídrido (ácido) mas H2O.
ÁCIDO + (H2O)

OXISALES: Compuestas
por la reacción de un hidróxido y un oxácido.

SALES BINARIAS: Compuestos por un
hidróxido y un hidrácido.
Bibliografía
- Material Didáctico Quimica 15
martes, 19 de mayo de 2015
TABLA DE VALENCIA DE ELEMENTOS QUÍMICOS
Tabla de Valencia de elementos Químicos
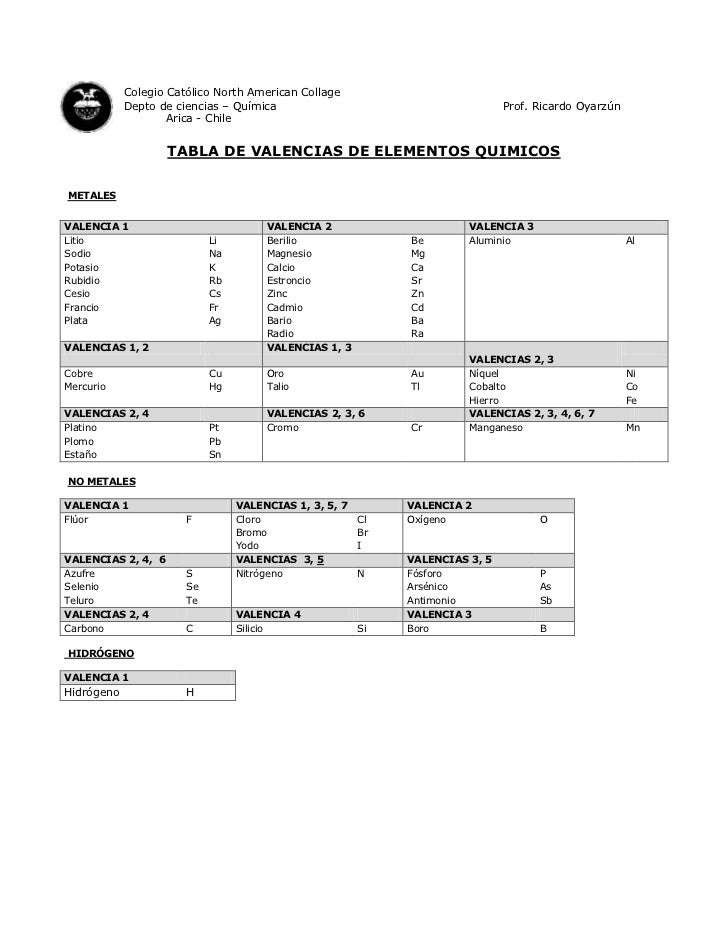
Bibliografía
- http://image.slidesharecdn.com/valencias-120331194050-phpapp02/95/tabla-de-valencias-elementos-qumicos-1-728.jpg?cb=1333224048
NÚMERO DE OXIDACIÓN
NÚMERO DE OXIDACIÓN
El número de oxidación es un número que representa el número de electrones que un átomo puede se signo positivo o negativo, cuando forma un compuesto determinado. Esto significa que el número de oxidación es positivo si el átomo pierde electrones, o los comparte con otro átomo que tenga tendencia a captarlos, y es negativo cuando el átomo gane electrones con uno que tenga tendencia a cederlos.
Bibliografía
- http://www.profesorenlinea.cl/Quimica/Oxidacion_numero_de.html
miércoles, 13 de mayo de 2015
MAPA CONCEPTUAL DE ENLACES
Mapa conceptual de Enlaces

Bibliografía
- http://www.cneq.unam.mx/cursos_diplomados/diplomados/medio_superior/ens_3/portafolios/quimica/equipo2/mapaconceptual.htm
TIPOS DE ENLACE QUÍMICO
Tipos de Enlace Químico
Un enlace iónico se puede definir como la fuerza que une a dos átomos a través de una cesión electrónica. Una cesión electrónica se da cuando un elemento electropositivo se une con un elemento electronegativo. Es necesario que uno de los elementos pueda ganar
electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).
Propiedades de los compuestos iónicos
Las sustancias iónicas están constituidas por iones ordenados en el retículo cristalino; las fuerzas que mantienen esta ordenación son fuerzas de Coulomb, muy intensas.
Enlace Covalente:

Es la fuerza que une dos átomos mediante la compartición de un electrón por átomo. Dentro de este tipo de enlace podemos encontrar dos tipos: el enlace covalente polar y el enlace covalente apolar. El primer sub-tipo corresponde a todos aquellos compuestos en donde la diferencia de electronegatividad de los átomos que lo componen va desde 0 hasta 1.7 (sin considerar el 0).
Propiedades de los compuestos covalentes
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles fuerzas de cohesión.
Enlace Metálico:


Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación.
Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado, por lo cual no es posible suponer el establecimiento de tantos enlaces covalentes.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
Bibliografía
- http://www.textoscientificos.com/quimica/enlaces-quimicos
- http://es-puraquimica.weebly.com/enlaces-quimicos.html
Suscribirse a:
Comentarios (Atom)
