Metales de la Tabla Periódica
Metales alcalinos (Grupo I):
- Del Li al Fr, reaccionan con otros elementos perdiendo 1 e-
- Son los más reactivos de entre los metales.
- Presentan baja dureza.
- Los más importantes son el Na y el K.
- Su configuración electrónica muestra un electrón en su capa de valencia.
- Son muy electropositivos: baja energía de ionización. Por tanto, pierden este electrón fácilmente (número de oxidación +1) y se unen mediante enlace iónico con otros elementos.
- En estado sólido forman redes cúbicas
- También reaccionan con el vapor de agua del aire o con la humedad de la piel.
- Son reductores poderosos, sus óxidos son básicos así como sus hidróxidos. Reaccionan directamente con los halógenos, el hidrógeno, el azufre y el fósforo originando los haluros, hidruros, sulfuros y fosfuros correspondientes.
- Casi todas las sales son solubles en agua, siendo menos solubles las de litio.
- Se emplean como refrigerantes líquidos en centrales nucleares (litio, sodio, potasio) y como conductores de corriente dentro de un revestimiento plástico.
- Sus compuestos tienen un gran número de aplicaciones.
- Todos ellos son metales excepto el hidrógeno que es un no metal.
- Todos ellos tienen como número de oxidación +1, excepto el hidrógeno que tiene +1 y -1.

Metales alcalinotérreos (Grupo II)
Los metales alcalinotérreos son, por orden de número atómico creciente, sus óxidos se llaman tierras alcalinas. Son llamados de tal forma por el nombre que recibían sus óxidos, tierras que tienen sus propiedades básicas (alcalinas), poseen una electronegatividad ≤ 1,57 según la escala de Pauling.
Los metales alcalinotérreos son, por orden de número atómico creciente, sus óxidos se llaman tierras alcalinas. Son llamados de tal forma por el nombre que recibían sus óxidos, tierras que tienen sus propiedades básicas (alcalinas), poseen una electronegatividad ≤ 1,57 según la escala de Pauling.
- Ligeramente duros.
- Buenos conductores de electricidad.
- Reaccionan perdiendo dos electrones.
- Son menos reactivos que los metales alcalinos.
- Los más importantes son el Ca y el Mg.

Metales de transición
Se definen como elementos cuyos átomos correspondientes no poseen un orbital “d” más energético totalmente completo o que son capaces de formar cationes con orbital d incompleto
- Elementos del grupos 3 al 12
- Son duros y brillosos
- Son buenos conductores de la electricidad.
- Los más comunes son : el Fe, Cu, Ni, Ag y Au

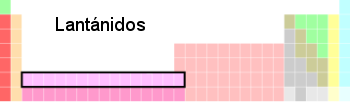
Lantánidos
Son llamados elementos de transición interna. Los lantánidos o tierras raras son los elementos químicos de la familia que comprende el Escandio (Sc) que posee un número atómico igual a 21, el Itrio (Y) de número atómico 39 y la serie de 15 elementos encabezados por el lantano (La), de números atómicos entre 57 y 71.
- Suaves, maleables.
- Presentan brillo, y una alta conductividad.
- Se mezclan con elementos comunes para formar aleaciones.
- Se encuentran en abundancia en la corteza terrestre, en minerales como la monacita.
Actínidos
Son llamados elementos de transición Interna, en total son 15 y tienen periodos cortos de vida.
- Son isótopos radiactivas.
- Solo el Ac, Th, Pa y U se encuentran de manera natural.
- El uranio se utiliza para producir energía en plantas nucleares.

Bibliografía
- Recurso Didáctico Química 15
- http://losmetalesalcalinos.blogspot.com/
- http://es.slideshare.net/Fidelgregoriramirez/grupo-iiade-la-tabla-peridica-de-los-elementos-metales-alcalinostrreos
- http://quimica.laguia2000.com/general/metales-de-transicion
- http://quimica.laguia2000.com/conceptos-basicos/lantanidos
No hay comentarios:
Publicar un comentario