RUTHERFORD
Nació el 30 de agosto de 1871, en Nelson, Nueva Zelanda. Hijo de un granjero, fue el cuarto de once hermanos.

Tras licenciarse, en 1893, en Christchurch (Nueva Zelanda), se trasladó a la Universidad de Cambridge (1895) para trabajar como ayudante de J.J. Thomson. A su regreso al Reino Unido (1907) se incorporó a la docencia en la Universidad de Manchester, y en 1919 sucedió al propio Thomson como director del Cavendish Laboratory de la Universidad de Cambridge.
Rutherford recibió el Premio Nobel de Química de 1908 en reconocimiento a sus investigaciones relativas a la desintegración de los elementos.
MODELO DE RUTHERFORD
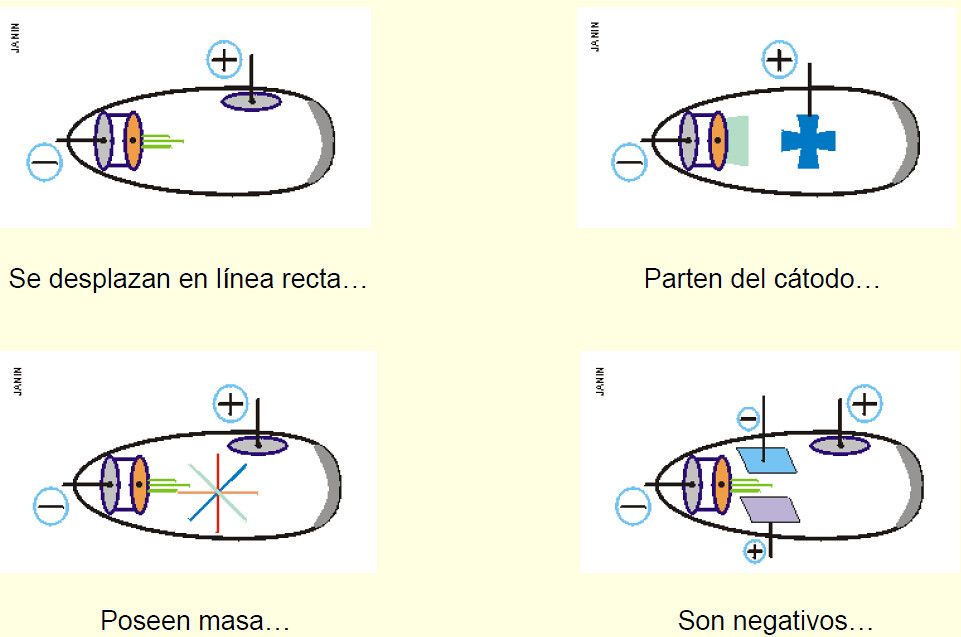
.png) Físico neozelandés que indicó en 1898 dos tipos de radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
Físico neozelandés que indicó en 1898 dos tipos de radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
El hecho de que sólo unas pocas radiaciones sufriesen desviaciones hizo suponer que las cargas que las desviaban estaban concentradas dentro de átomos ocupando un espacio muy pequeño en comparación a todo el tamaño atómico; esta parte del átomo con electricidad positiva fue llamada NÚCLEO.
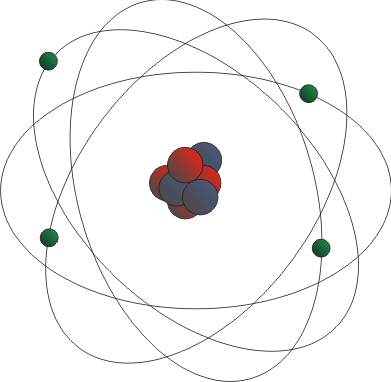
 En el modelo de Rutherford, los electrones se movían alrededor del núcleo, como los planetas al rededor del Sol. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
En el modelo de Rutherford, los electrones se movían alrededor del núcleo, como los planetas al rededor del Sol. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
Los
electrones no caían en el núcleo, ya que la fuerza de atracción electrostática
era contrarrestada por la tendencia del electrón a continuar moviéndose en
línea recta.
DEFICIENCIAS DEL MODELO DE RUTHERFORD
La falla del modelo de Rutherford radica en el planteamiento de que toda partícula eléctrica, separada de su posición de equilibrio, vibra con una frecuencia determinada, originando la emisión de una onda electromagnética. Esta vibración disminuye cuando pierde energía, hasta quedar en reposo, por lo que la fuerza centrífuga se anula, ocasionando un choque entre el electrón y el núcleo.
“El electrón gira formando un espiral en dirección al núcleo, perdiendo energía en forma del espectro de luz visible, hasta que este impactara con el centro del átomo (núcleo).”
BIBLIOGRAFÍA
- http://www.biografiasyvidas.com/biografia/r/rutherford.htm
- Recurso Didáctico Química 15
- http://2aquimica.blogspot.com/2008/05/fallas-de-teoras-modelos-atmicos.html